C5.8 标签,标识和标识控制
机构应制定产品和样品的标签,标识政策、过程和程序。至少应明确:
(1)细胞治疗产品标签模板的获取和创建。
(2)验证标签纸是否符合自定义规定。
(3)使用前对标签进行鉴定、审查和批准。适用标 准 6.1.2。
(4)适当的控制以确保正确识别细胞疗法产品。
(5)标签的库存和模板,包括报废的控制。适用 6. 文件和记录。
C5.8.1 细胞疗法产品的标签应符合最新版本的 ISBT 128 或欧洲设计规范的标签。适用标准 5.7。
5.8.1.1 在采集时,单采和骨髓产品应使用 ISBT 128 或欧洲代码规范标签。
5.8.1.1.1 其他细胞治疗产品在采集时应标识正确的 产品名称和唯一的字母或数字标签。
5.8.1.2 在处理完成时,细胞治疗产品应使用 ISBT 128 或欧洲设计规范标签。
5.8.1.3 接收机构应有一个适当的流程以追溯不同系统或版本中标识的产品。
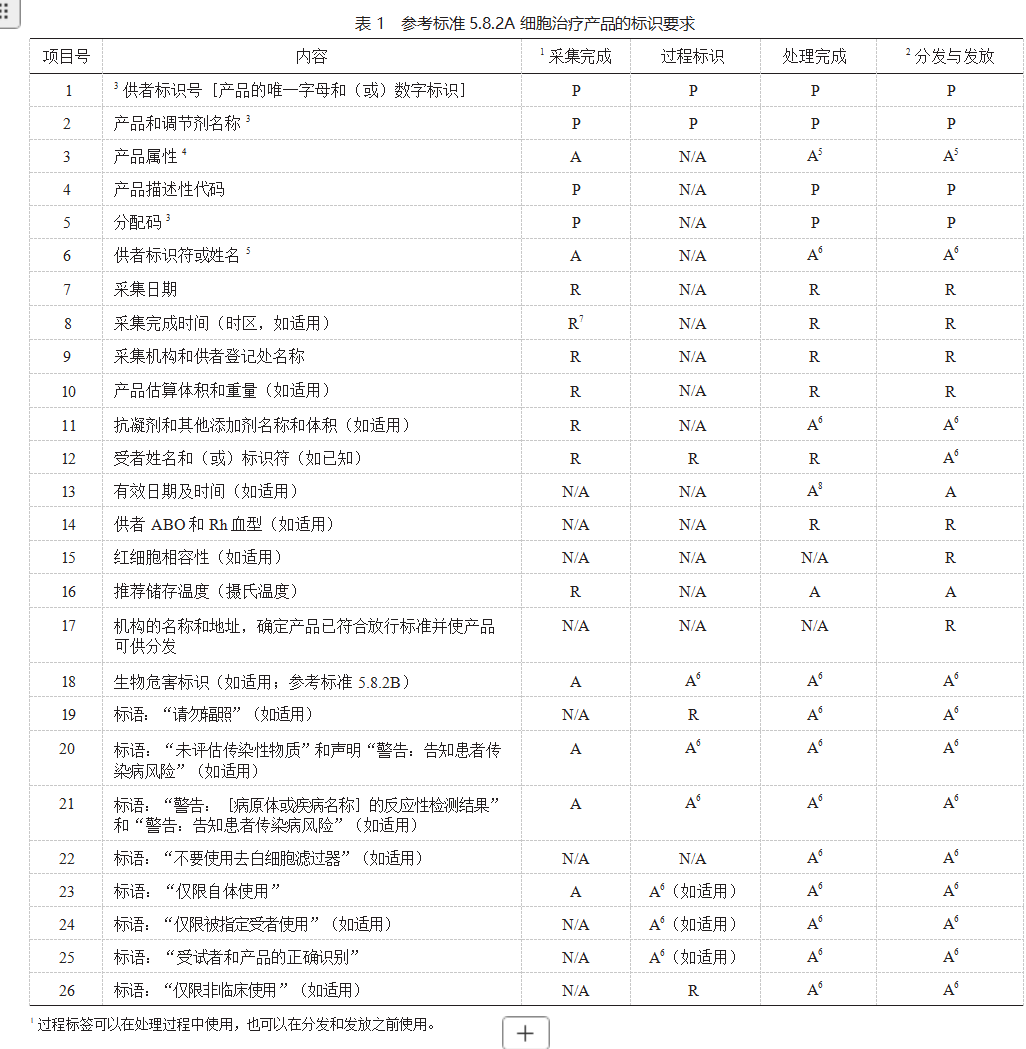
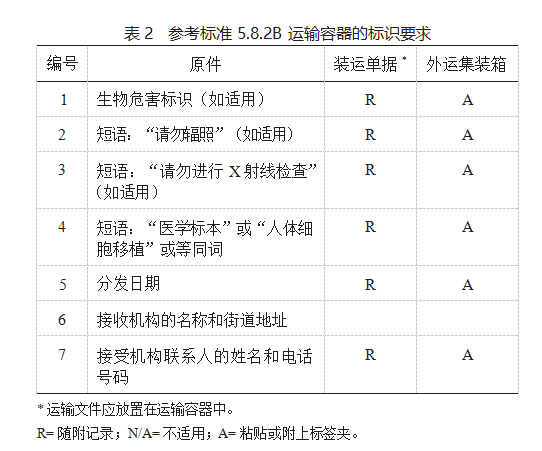
5.8.2 所有原材料,细胞治疗产品和最终产品的容 器均应按照参考标准 5.8.2A 细胞治疗产品的标识要求 (表 1)和参考标准 5.8.2B 运输容器的标识要求进行标识(表 2)。
5.8.2.1 受监管的研究产品应根据当地和(或)国家 法规进行标识。
5.8.2.2 已通过地方和(或)国家政府批准或许可的 产品,应根据许可或批准的条款进行标识。
2 在产品发放或运输之前,其分发的最终的标识信息应在容器上或容器中。
3 适用标准 5.8.1。
4 独特定义细胞疗法产品的其他特征。需要一组称为核心条件的属性。这些条件包括抗凝剂和(或)添加剂,标示采集量和储存温度。标识术语应符合当前的 ICCBBA 要求。
5 在必须保持供者匿名的情况下,例如来自无关供者注册处的产品,则无需此信息。
6 如果在容器上粘贴或附加适用的警告和声明在物理上是不可能的,那么标识必须与人体细胞、组织以及基于细胞和组织的产品附在一起。
7 时区只适用于当采集机构和处理机构不一致情况下。
8 如果在处理结束时未在冷冻保存产品上附加有效期,则应在冷冻保存产品放行时提供稳定性研究记录以证明有效期。
P= 永久性粘贴;A= 贴附(可能是永久性粘贴);R = 随附记录;N/A = 不适用。
C5.8.3 包装和标识
标识信息应进行验证,以确保准确性和完整性。
5.8.3.1 采集机构应在采集后立即核实标识。
5.8.3.2 处理和(或)存储机构应至少在以下时间核 实标识:
(1)在处理和(或)存储机构收到后。
(2)在机构定义的流程步骤,包括转移到不同的存 储位置和移除或取回附加物和(或)样品(如适用)。
(3)在处理完成时和(或)在存储之前。
(4)分发或发放之前。
5.8.3.3 给药机构应在使用细胞治疗产品之前核实 标识。
5.8.4 标签术语
用于产品标签上的产品名称、属性和描述应参照 “人类医疗产品标准术语”中的定义。



















 18576401396
18576401396 





